„B sejt és autoimmunitás" kutatócsoport
„B sejt és autoimmunitás” kutatócsoport
A kutatócsoport vezetője:
Sármay Gabriella, Ph.D., D.Sc., nyugalmazott egyetemi tanár, professor emerita
A kutatócsoport tagjai:
Gyebrovszki Balázs, doktorandusz
Mustafa Talib, doktorandusz
Bőgér Dorottya, 2. éves Msc hallgató
Kutatási terület:
Érdeklődésem középpontjában a B sejtes immunválasz szabályozása, a B sejtek receptorai által stimulált jelátviteli folyamatok és a receptorok közötti "párbeszéd”, valamint az autoimmun betegségek tanulmányozása állnak. A különböző receptorok által közvetített jelek együttesen szabályozzák a B sejtek negatív és pozitív szelekcióját, amely folyamatoknak fontos szerepe van az immunológiai tolerancia fenntartásában. A hibás szabályozás a tolerancia áttöréséhez és autoimmun betegségek kialakulásához vezethet.
Korábbi kutatómunkánk során vizsgáltuk az IgG konstans (Fc) részét felismerő Fcγ receptorok (FcγR) funkcióit, azonosítottuk azokat a kinázokat és foszfatázokat, amelyek felelősek az FcγRIIb által közvetített B-sejt gátlás kialakulásáért; tanulmányoztuk az éretlen és érett B-sejtekben zajló a jelátviteli folyamatok közötti eltéréseket, valamint a jelátvitel szabályozásában fontos szerepet betöltő adaptor fehérje, a Grb2-associated binder (Gab1 és Gab2) molekulák szerepét a BCR közvetített jelátvitelben.
A jelátviteli folyamatokban, vagy a receptorok közötti párbeszéd során bekövetkező hibák, „téves kapcsolások” azt eredményezhetik, hogy például olyan B-sejtek, amelyek saját fehérjéket ismernek fel nem pusztulnak el, hanem kiszabadulva az ellenőrző mechanizmusok alól életben maradnak, aktiválódnak, és a szervezet saját fehérjéi/sejtjei ellen fordulnak, autoantitesteket termelnek, ami a saját anyagok károsodásához, gyulladási folyamatok, végső soron autoimmun betegségek kialakulásához vezethet.
Az utóbbi években figyelmünk egy szisztémás autoimmun betegség, a Rheumatoid arthritis (RA) felé fordult. Az RA gyulladásos autoimmun betegség, a kis izületek porc és csontállományának degradációjával jár, és jelenleg nem gyógyítható. A betegek kb. 70 %-ának szérumában posztranszlációsan módosult, citrullinált fehérjék elleni ellenanyagok vannak jelen (anti-citrullinált protein/peptid antitestek, ACPA), ezek kimutatása az RA legérzékenyebb diagnosztikai módszere.
Jelenleg folyó kutatási projektek:
1) Munkacsoportunk részt vesz a Kacskovics Imre professzor által vezetett, MOLEKULÁRIS BIOMARKER KUTATÁSI ÉS SZOLGÁLTATÁSI KÖZPONT KIALAKÍTÁSA AZ IPARI IGÉNYEK KISZOLGÁLÁSA ÉRDEKÉBEN, ELTE BIOTECHNOLÓGIA FELSŐOKTATÁSI ÉS IPARI EGYÜTTMŰKÖDÉSI KÖZPONT (FIEK_16-1-2016-0005) pályázat keretében zajló molekuláris biomarker kutatásban, kapcsolódva a „HUMORÁLIS IMMUNVÁLASZ, IMMUNBIOTECHNOLÓGIA” kutatócsoport munkájához. A regulátor B sejteket és az intracelluláris citokinek termelését vizsgáljuk egészségesekből és RA betegekből származó B limfocitákban. Célunk a magas RA kockázatú csoportban levő, de még nem RA betegek korai kiszűrése, ami lehetővé tenné a korai terápia elkezdését. Nyomon követjük továbbá a különféle biológiai terápiák alatt álló betegek citokin termelési profiljának alakulását, a terápia hatékonyságának vizsgálata céljából.
2) Egy további az NKFIH által támogatott projektben (K_16, 119549, FEHÉRJÉK GLIKOZILÁCIÓJÁNAK ÖSSZEHASONLÍTÓ VIZSGÁLATA RHEUMATOID ARTHRITISBEN) az MTA TTK –val (Prof. Dr. Vékey Károly) kollaborációban a citrullinált fehérjék ellen termelődő autoantitestek (ACPA) glikozilációját vizsgáljuk. Célunk az ACPA és az egészségesekből származó IgG eltérő glikozilációs mintázatának összehasonlítása, valamint a különböző IgG glikoformák Fcγ receptorokhoz való kötődése által közvetített funkciók közötti eltérések azonosítása.
3) Harmadik, NKFIH által támogatott (K_18, 128546 számú) most induló projektünkben a regulátor B sejtek állnak kutatásunk középpontjában.
REGULÁTOR B SEJTEK ÉS FOLLIKULÁRIS T SEJT ALCSOPORTOK KÖZÖTTI EGYÜTTMŰKÖDÉS EGÉSZSÉGESEKBEN ÉS GYULLADÁSOS AUTOIMMUN BETEGSÉGBEN
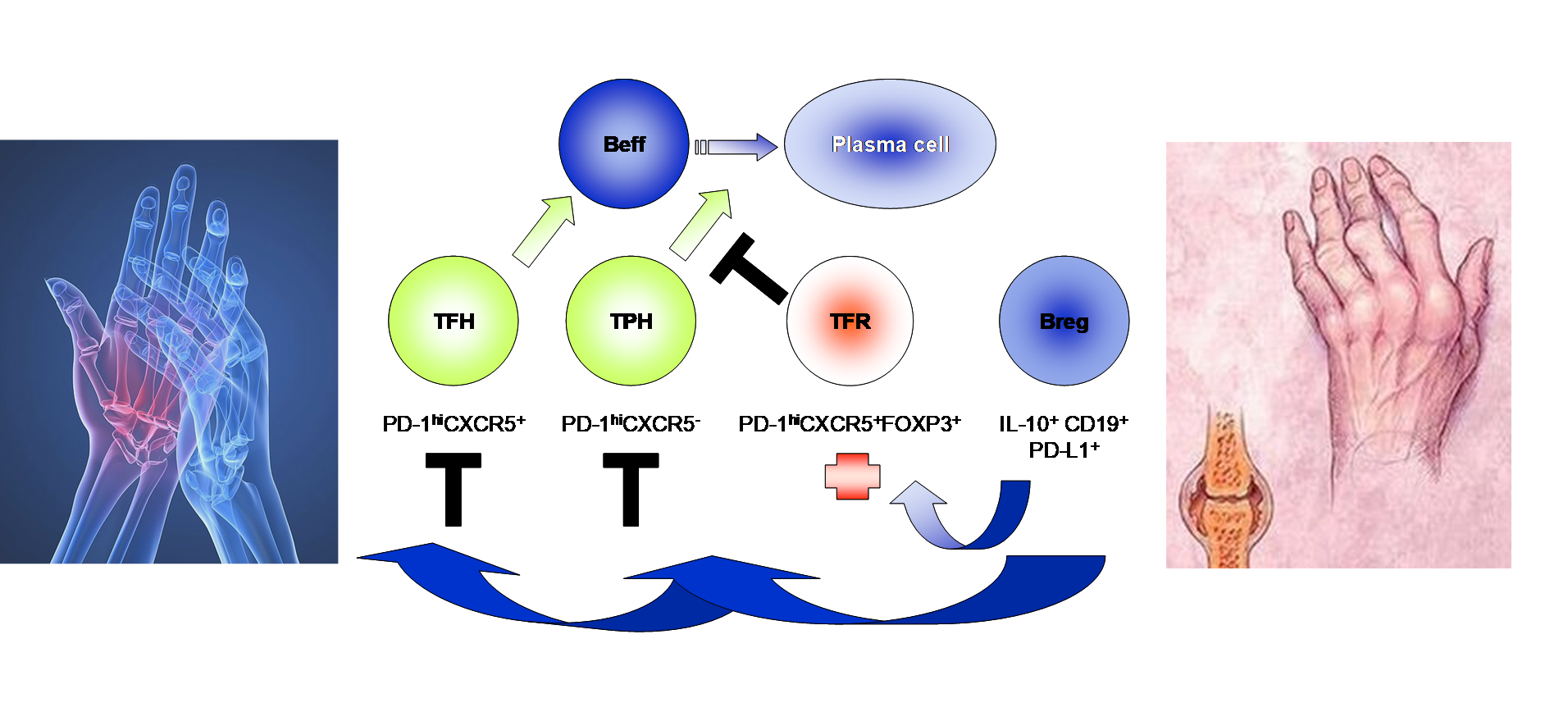
Hipotézis: a hibás T- és B-sejtek közötti kölcsönhatások hozzájárulhatnak az RA kialakulásához.
Beff: effektor B-sejt, TFH: follikuláris helper T-sejt, TPH: perifériás helper T-sejt, TFR: follikulláris regulátor T-sejt, Breg: regulátor B-sejt
Az immunrendszer szigorúan szabályozott működésébe időnként hiba csúszhat: ilyenkor az immunsejtek a toleranciát áttörve saját sejtek, szövetek ellen fordulnak, gyulladás és szövetkárosodás alakul ki. A reumatoid artritisz (RA) gyulladásos autoimmun betegség, amely az izületek gyulladásával, csont erózióval jár. Célunk annak felderítése, hogy az egyes szabályozó (regulátor) B- és T- sejtek (Breg,Tfr és Tfh) közötti együttműködést tekintve van-e különbség a RA betegek és egészségesek között. Szeretnénk feltárni a hibás szabályozási mechanizmusokat, továbbá azt, hogy megfigyelhető-e összefüggés az esetleges eltérések, valamint a betegség súlyossága, lefolyása között.
Várható eredményeink hozzájárulnak az RA patomechanizmusa jobb megértéséhez és a jövőben specifikusabb diagnosztikum/terápia fejlesztéséhez.
Kutatásainkat támogatja:


